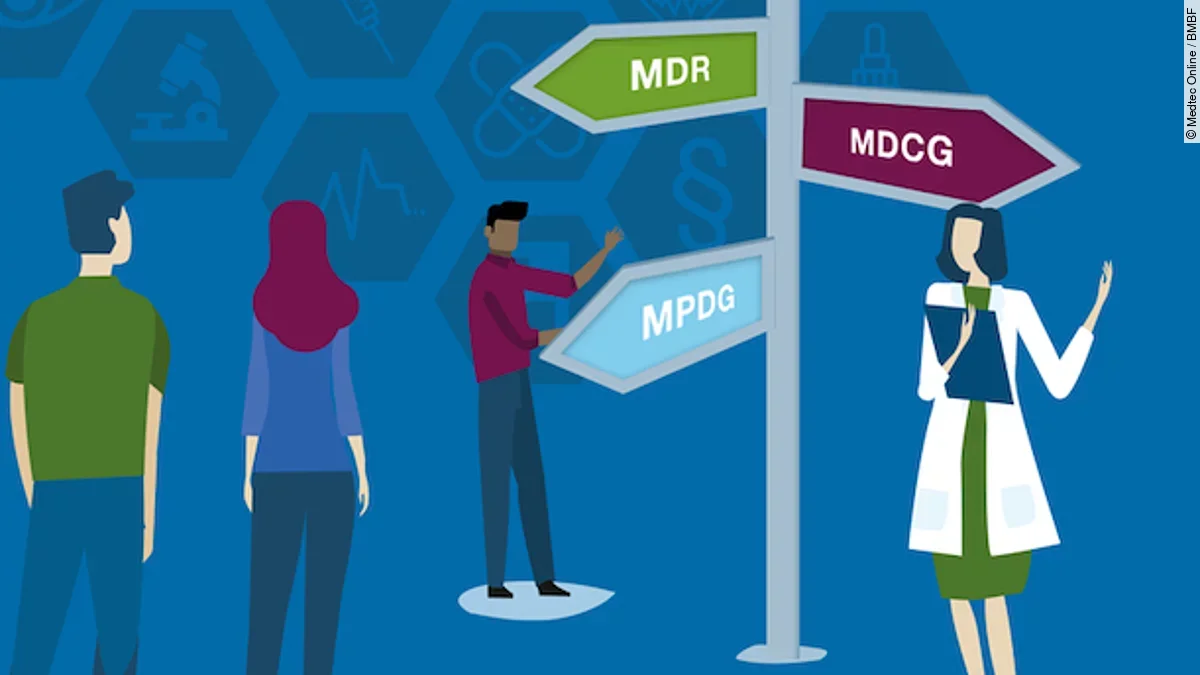
Kürzlich veröffentlichte das vom Bundesministerium für Bildung und Forschung (BMBF) initiierte Nationale Community-Portal Medtec Online den Leitfaden „Regulatorische Einordnung von klinischen Studien mit Medizinprodukten“. Dieser soll Antragsteller und Prüfinstanzen bei der regulatorischen Einordnung von klinischen Studien unterstützen, da sich die Vorschriften hierfür durch die EU-Verordnung über Medizinprodukte (MDR) seit 2021 erheblich geändert haben. Ziel des Leitfadens ist es, einen Beitrag zu einer einheitlichen Rechtsauffassung und Auslegungspraxis aller Beteiligten zu leisten.
Gemeinsame Weiterentwicklung erwünscht
Der Leitfaden ist ein Ergebnis des Strategischen BMBF-Dialogs „Klinische Machbarkeitsstudien“, der im Jahr 2022 auf Medtec Online durchgeführt wurde. Zur Hervorhebung seines Referenzcharakters wurde der Medtec Online-Leitfaden parallel auf den Seiten des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) zweitveröffentlicht. Zur Qualifizierung von Studien als klinische Prüfung nach Medizinprodukterecht und zur anschließenden Typisierung wurden im Austausch mit Vertretern diverser Prüfinstanzen Prüfschemata entwickelt und im Leitfaden publiziert. Dabei ist auch eine Beteiligung von Akteuren der Fachkreise an der Weiterentwicklung des Leitfadens möglich und erwünscht.
Rechtslage grundlegend geändert
Mit Geltungsbeginn der EU-Verordnung über Medizinprodukte (MDR) und dem Medizinprodukterecht-Durchführungsgesetz (MPDG) im Mai 2021 hat sich die Rechtslage bei klinischen Machbarkeitsstudien mit innovativen Medizinprodukten grundlegend geändert: Produktzentrierte klinische Machbarkeitsstudien fallen nunmehr durchweg unter den Geltungsbereich des Medizinprodukterechts. Zusätzlich können erhöhte regulatorischen Anforderungen und deren teilweise Vorverlagerung in die Forschungsphase erhebliche Auswirkungen auf das Innovationsgeschehen haben.
Der Medtec Online-Leitfaden dient zur regulatorischen Einordnung klinischer Studien, die in Deutschland grundsätzlich als klinische Prüfungen unter der MDR i. V. m. dem Medizinprodukterecht-Durchführungsgesetz (MPDG) in Betracht kommen könnten. Der Anwendungsbereich des Leitfadens erstreckt sich jedoch auf jedwede klinische Studie unter Einbezug von (Medizin-)Produkten, gleich ob in der Forschungs-, Entwicklungs- oder Marktphase.
Prüfschemata und zahlreiche Fallbeispiele
Vertreterinnen und Vertreter von Ministerien, Behörden, Ethik-Kommissionen, spezialisierten öffentlichen wie privaten Dienstleistern und Fachanwälte waren an der Entwicklung des Medtec Online-Leitfadens beteiligt. Zuvor identifizierten die Beteiligten in der Fokusgruppe die Schaffung der notwendigen Transparenz hinsichtlich der regulatorischen Einordnung von Klinischen Machbarkeitsstudien mit Medizinprodukten für Antragsteller und Prüfinstanzen als zentralen Handlungsbedarf.
Neben den Prüfschemata als Kernstücke enthält der Online-Leitfaden einen Einblick in die regulatorischen Grundlagen, eine präzise Klärung des Anwendungsbereichs sowie vor allem zahlreiche praxisnahe Fallbeispiele und ein umfangreiches Frage-Antwort-Kapitel. Im Anhang finden sich Arbeitshilfen in Form von Vorlagen, Glossarbegriffen und Checklisten.


Derzeit sind noch keine Kommentare vorhanden. Schreiben Sie den ersten Kommentar!
Jetzt einloggen